北京市药品监督管理局关于对《关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》公开征集意见的公告
为贯彻落实《医疗器械监督管理条例》(中华人民共和国国务院令第739号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)规定,按照国家药品监督管理局《关于第一类医疗器械备案有关事项的公告》(2022年第62号)、《关于实施〈医疗器械注册与备案管理办法〉〈体外诊断试剂注册与备案管理办法〉有关事项的通知》(京药监发〔2022〕108号)等相关文件要求,为科学开展本市第一类医疗器械(含第一类体外诊断试剂)产品备案管理工作,结合我市实际,北京市药品监督管理局起草了《关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》,现向社会公开征求意见,欢迎社会各界提出意见建议。
公开征集意见时间为:2023年2月6日至2月13日。
意见反馈渠道如下:
一、电子邮箱:ylqxzcglc@yjj.beijing.gov.cn(邮件名称请注明:《关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》反馈意见)。
二、通讯地址:北京市西城区枣林前街70号中环广场A座1517房间,北京市药品监督管理局医疗器械注册管理处 邮编100053。
三、电话:010-83979559
四、传真:010-83560780
五、登录北京市人民政府网站(http://www.beijing.gov.cn),在“政民互动”版块下的“政策性文件意见征集”专栏中提出意见。
附件:1.关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)
2.《北京市药品监督管理局关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》起草说明
附件:
北京市药品监督管理局关于第一类医疗器械产品备案有关事宜的通知
(征求意见稿)
各相关单位:
为贯彻落实《医疗器械监督管理条例》(中华人民共和国国务院令第739号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)规定,按照国家药品监督管理局《关于第一类医疗器械备案有关事项的公告》(2022年第62号)、《关于实施〈医疗器械注册与备案管理办法〉〈体外诊断试剂注册与备案管理办法〉有关事项的通知》(京药监发〔2022〕108号)等相关文件要求,为科学开展本市第一类医疗器械(含第一类体外诊断试剂)产品备案管理工作,现将有关事宜通知如下:
依据《北京市药品监督管理局分局履职公告》(公告〔2020〕38号)规定,第一类医疗器械产品备案管理工作由各区市场监管部门负责。第一类医疗器械产品备案人(以下简称备案人)应当按照法定程序和要求向各区市场监管部门办理备案。
(一)办理第一类医疗器械产品备案事项应当执行以下程序:
(二)备案人可登录首都之窗(www.beijing.gov.cn)或北京市药品监督管理局政府网站(http://yjj.beijing.gov.cn/)企业服务平台办理第一类医疗器械产品备案。备案人应当提交符合要求的备案资料(附件1),填写《第一类医疗器械备案表》(附件2)。备案人应当确保提交的资料合法、真实、准确、完整和可追溯。
(三)涉及产品管理类别判定的,备案人应当结合产品实际情况,根据《第一类医疗器械产品目录》《体外诊断试剂分类子目录》等规定中产品描述、预期用途和品名举例进行判定。判定为第一类医疗器械的,备案人向各区市场监管部门办理备案;超出目录内容的,申请分类界定,经判定明确为第一类医疗器械的,向各区市场监管部门办理备案。
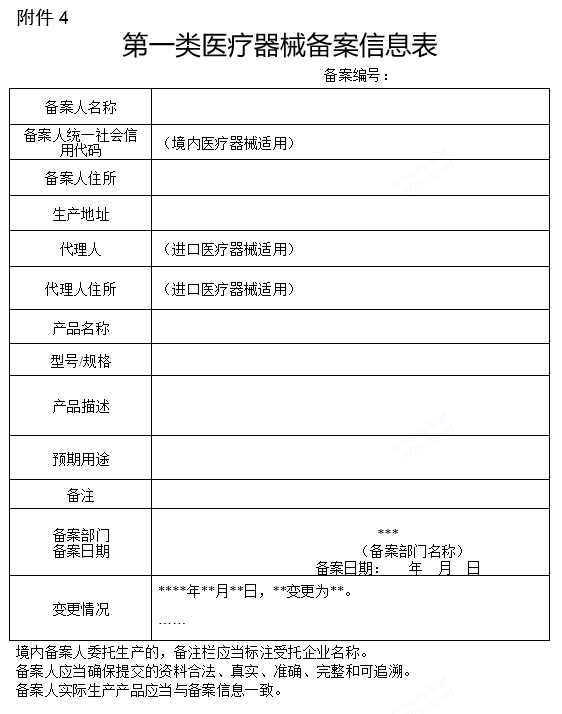
(四)备案人提交符合要求的产品备案资料后即完成备案。各区市场监管部门向备案人提供备案编号(《第一类医疗器械备案编号告知书》见附件3),并按照规定公示《第一类医疗器械备案信息表》、《第一类体外诊断试剂备案信息表》(附件4)中登载的有关信息。
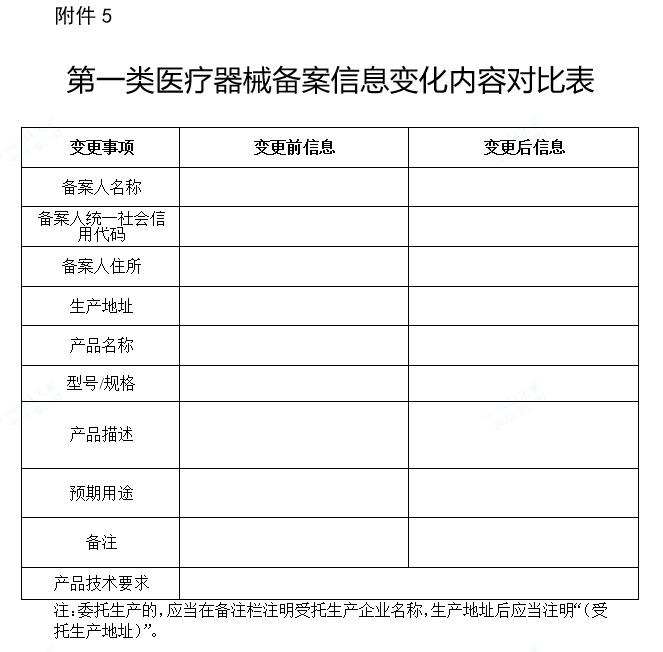
(一)已备案的第一类医疗器械,《第一类医疗器械备案信息表》、《第一类体外诊断试剂备案信息表》中登载内容及备案的产品技术要求发生变化,备案人应当向原备案部门变更备案,并提交变化情况的说明及相关文件(附件1、附件5)。对变更备案的第一类医疗器械,各区市场监管部门应当将变更情况登载于《第一类医疗器械备案信息表》、《第一类体外诊断试剂备案信息表》“变更情况”栏中,并按照规定公示变更情况相关信息。
(二)备案人主动提出取消产品备案的,各区市场监管部门应当按照程序办理。
(三)备案人住所迁出原所在辖区的,应当向现所在地区市场监管部门重新提出产品备案,并应当向原所在地区市场监管部门提出取消产品备案,未取消原产品备案的,原所在地区市场监管部门可以公告取消其产品备案。
(四)已备案的医疗器械管理类别调整为第二类、第三类和不作为医疗器械管理的,备案人应当在有关医疗器械类别调整规定时限内主动向所在地区市场监管部门提出取消产品备案。备案人未在规定时限内取消产品备案的,所在地区市场监管部门可以公告取消其产品备案。
(五)《营业执照》被依法注销或吊销的,备案人应当及时向所在地区市场监管部门提出取消产品备案,未取消产品备案的,《第一类医疗器械备案凭证》或《第一类医疗器械备案编号告知书》自动失效,所在地区市场监管部门可以公告取消其产品备案。
(六)备案人应当开展产品再评价工作,如结果表明已上市产品不能保证安全、有效的,应当主动申请取消产品备案,未提出取消产品备案的,所在地区市场监管部门可以公告取消其产品备案。
(七)备案人取消产品备案之日起不得再继续生产医疗器械。取消产品备案相关信息由各区市场监管部门报北京市药品监督管理局,并通过政府网站向社会进行公示。
(一)本通知发布之日前已取得的《第一类医疗器械备案凭证》继续有效。本通知发布之日起,备案人变更备案的,将按照国家药品监督管理局相关规定执行,发放《第一类医疗器械备案编号告知书》。
(二)《第一类医疗器械备案凭证》遗失补办事项适用于备案凭证的遗失补办,《第一类医疗器械备案编号告知书》遗失不再办理补办,由备案人登录企业服务平台自行打印电子《第一类医疗器械备案编号告知书》。
(三)因《第一类医疗器械备案凭证》变更为《第一类医疗器械备案编号告知书》导致企业现有库存产品标签、说明书和包装材料的文字性改变,如备案编号由“京东械备20210012号”变更为“京东械备20210012”的情形,可继续使用至2023年8月31日,但标签、标识和说明书内容应当符合现行法律、法规、规章和强制性标准的规定。
(五)第一类医疗器械产品备案电子凭证与纸质凭证具有同等法律效力。
(六)本通知自发布之日起施行。《北京市食品药品监督管理局关于医疗器械备案有关事宜的通知》(京食药监械监〔2014〕39号)中有关产品备案要求与本通知内容不符的,按照本通知规定执行。国家药品监督管理局另有文件规定的,按照其规定执行。
北京市药品监督管理局
2023年2月6日
附件:1.第一类医疗器械备案资料要求及说明
2.《第一类医疗器械备案表》(格式)
3.《第一类医疗器械备案编号告知书》(格式)
4.《第一类医疗器械备案信息表》和《第一类体外诊断试剂备案信息表》(格式)
5.《第一类医疗器械备案信息变化内容对比表》和《第一类体外诊断试剂备案信息变化内容对比表》(格式)
附件1:
第一类医疗器械备案资料要求及说明
委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议复印件。
产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制,主要包括医疗器械成品的可进行客观判定的功能性、安全性指标和检测方法。
产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。备案人委托第三方检验机构检验或开展自检的,应当符合《关于实施〈医疗器械注册与备案管理办法〉〈体外诊断试剂注册与备案管理办法〉有关事项的通知》(京药监发〔2022〕108号)规定。
检验报告后随附产品实物照片。产品实物照片应当包括拆除所有内外包装后的样品实物照片,以及内外包装实样照片。多个型号规格的,提供典型产品的照片。
说明书和标签应当符合《医疗器械说明书和标签管理规定》《体外诊断试剂说明书编写指导原则》等相关要求,说明书中产品性能应当与产品技术要求中的相应内容一致。
对生产过程相关情况的概述。无源医疗器械应明确产品生产加工工艺,注明关键工艺。有源医疗器械应提供产品生产工艺过程的描述性资料,可采用流程图的形式,或生产过程的概述。体外诊断试剂应概述主要生产工艺,包括:固相载体、显色系统等的描述及确定依据,反应体系包括样本采集及处理、样本要求、样本用量、试剂用量、反应条件、校准方法(如果需要)、质控方法等。
有多个研制、生产场地的,应当概述每个研制、生产场地的实际情况。
委托其他企业生产的,应当列出受托企业名称、住所、生产地址。
2. 声明本产品符合有关分类的要求及依据,包括《第一类医疗器械产品目录》或《体外诊断试剂分类子目录》的有关内容,应当注明确切的产品分类依据,明确所属子目录、一级、二级产品类别;
3. 声明本产品符合现行国家标准、行业标准并提供符合标准的清单;
递交资料时,不是法定代表人或负责人本人的,应当提交。
涉及产品技术要求变化的,应提供产品技术要求变化内容对比表及产品检验报告(如涉及)。
如变更事项涉及备案的关联文件变化的,应当提交新的关联文件。
2. 声明本产品符合有关分类的要求及依据,包括《第一类医疗器械产品目录》或《体外诊断试剂分类子目录》的有关内容,应当注明确切的产品分类依据,明确所属子目录、一级、二级产品类别;
3. 声明本产品符合现行国家标准、行业标准并提供符合标准的清单;
递交资料时,不是法定代表人或负责人本人的,应当提交。
(三)第一类医疗器械备案凭证遗失情况说明(生成电子告知书,自行打印)
递交资料时,不是法定代表人或负责人本人的,应当提交。
递交资料时,不是法定代表人或负责人本人的,应当提交。
产品名称(不包括体外诊断试剂)原则上应当直接使用《第一类医疗器械产品目录》中“品名举例”所列举的名称;对于确有需要调整产品名称进行备案的,应当采用符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)及相关命名指导原则的名称。
体外诊断试剂产品分类名称(产品名称)应当采用《体外诊断试剂分类子目录》中的产品分类名称(产品名称)。
“产品描述”和 “预期用途”应当符合《第一类医疗器械产品目录》和《体外诊断试剂分类子目录》(以下统称目录)中相应要求,不应超出目录中“产品描述”和 “预期用途”和相关内容的范围。
《第一类医疗器械产品目录》中产品描述项下使用“通常由……组成”时,相关内容只是给出了产品的代表性结构组成。备案时,可以根据备案产品的实际情况,描述结构组成;描述时,不可使用“通常由……组成”,而应使用“由……组成”,并写明具体的组成。有“一次性使用”“重复性使用”“无源产品”“粘贴部位为完好皮肤”“不具有剂量控制功能”“非无菌提供”等限定性表述的,备案产品“产品描述”应当明确。
型号/规格不应包含存在明示或暗示治疗疾病、夸大预期用途或者其他具有误导性欺骗性的内容。
境内备案人备案表中的备案人名称、住所应当与企业营业执照或事业单位法人证书中一致。
说明书中涉及产品描述的内容(包括但不限于结构组成、主要组成成分、预期用途、使用方式、注意事项等涉及产品描述的部分)不得超出其他备案资料中的相应内容。
如产品使用前由使用机构根据说明书进行灭菌或消毒,在备案时提交的产品说明书中应提供经验证的灭菌或消毒方法。
(二)各项文件除关联文件外均应以中文形式提供。如关联文件为外文形式还应提供中文译本并由代理人签章。根据外文资料翻译的资料,应当同时提供原文。
(三)产品备案资料如无特殊说明的,应当由备案人签章。“签章”是指:备案人盖公章,或者其法定代表人、负责人签名加盖备案人公章。
(四)备案人提交纸质备案资料的,备案资料应当有所提交资料目录,包括备案资料的一级和二级标题,并以表格形式说明每项的页码。
(一)对于以下两种情形的产品,应当按下述要求备案:
1.对于出厂时为非无菌提供的,使用前需由使用机构根据说明书进行灭菌或消毒,以满足临床需求的第一类医疗器械产品(例如:非无菌提供的可重复使用眼科手术刀),“产品描述”项下应当写明“非无菌提供,使用前由使用机构根据说明书进行灭菌”或“非无菌提供,使用前由使用机构根据说明书进行消毒”;“产品说明书”中应当提供灭菌或消毒方法,所提供的灭菌、消毒方法和产品可以承受的灭菌、消毒次数应经过确认。
2.对于出厂时为非无菌提供的,使用前不再进行灭菌或消毒,但为了满足临床需求本身具有微生物限度要求的第一类医疗器械产品(例如:接触创面的按第一类医疗器械管理的创口贴),“产品描述”项下应当写明需符合的微生物限度要求;“产品技术要求”中应当写明需符合的微生物限度要求;“生产制造信息”中应当写明:为使产品符合规定的微生物限度要求,生产者采取了哪些措施;目前符合哪项标准规定的微生物限度要求(如适用)。
(二)《第一类医疗器械产品目录》中“09-02-03物理降温设备”“09-03-08光治疗设备附件”“14-10-02创口贴”“20-03-11穴位压力刺激器具”四类产品,不能含有中药、化学药物、生物制品、消毒和抗菌成分、天然植物及其提取物等发挥药理学、免疫学、代谢作用的成分或者可被人体吸收的成分,包括但不限于《第一类医疗器械产品目录》附录所列成分。
《第一类医疗器械产品目录》“09-02-03物理降温设备”备案时,产品名称应当直接使用目录“品名举例”所列举的名称,预期用途不得超出目录规定的预期用途。
(三)关于组合包类产品。由需配合使用从而实现某一预期用途的一种以上医疗器械组合而成的产品,若组合中所有产品均为第一类医疗器械(不得含有任何形式的非医疗器械产品),且组合后不改变各组成器械的预期用途,可按照第一类医疗器械备案。其产品名称应体现组合特性,原则上按其主要临床预期用途命名,名称的组成内容应在所属目录“产品类别(一级或者二级)”、所含各产品的“预期用途”范围内,如上肢内固定手术器械(包)、膝关节手术器械(包)等。同时,“产品描述”应包含所有组成的医疗器械,并说明各组成医疗器械的“产品描述”和“预期用途”,且其基本内容均应与目录中的相应内容一致。组合包类产品以包内对其预期用途起主要作用的医疗器械的分类编码作为该组合包的分类编码。






《北京市药品监督管理局关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》起草说明
为进一步做好第一类医疗器械备案工作,强化注册人备案人主体责任,保障公众用械安全,北京市药品监督管理局起草了《关于第一类医疗器械产品备案有关事宜的通知(征求意见稿)》,现就起草情况说明如下:
2021年,国务院发布新修订《医疗器械监督管理条例》,市场监管总局修订发布《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》,国家药监局修订发布《第一类医疗器械产品目录》;2022年,国家药监局修订发布《关于第一类医疗器械备案有关事项的公告》(以下简称《公告》),新的法规文件对第一类医疗器械备案工作明确了新的要求,为进一步做好本市第一类医疗器械备案工作,制定本通知。
《医疗器械监督管理条例》(中华人民共和国国务院令第739号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)、《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),国家药品监督管理局《关于第一类医疗器械备案有关事项的公告》(2022年第62号)、《关于实施〈医疗器械注册与备案管理办法〉〈体外诊断试剂注册与备案管理办法〉有关事项的通知》(京药监发〔2022〕108号)等法规文件和相关工作要求。
本通知共有四部分内容,分别对产品备案管理工作责任主体、产品备案工作要求和流程、产品变更备案和取消备案工作要求和流程及备案的其他要求作出了规定。
根据《公告》相关要求,备案部门以“备案编号告知书”的方式提供备案编号,不再提供“备案凭证”。本通知发布之日起,备案人变更备案的,将按照国家药监局相关规定执行,发放《第一类医疗器械备案编号告知书》。备案部门可以向备案人提供纸质的备案编号告知书,也可以通过信息化手段向备案人推送电子版本的备案编号告知书。
第一类医疗器械备案凭证(体外诊断试剂)遗失补办事项适用于备案凭证的遗失补办,《第一类医疗器械备案编号告知书》遗失不再办理补办,由备案人登录企业服务平台自行打印电子《第一类医疗器械备案编号告知书》。
本公告中明确了取消备案的5种情形:一是备案人主动提出取消产品备案的;二是备案人住所迁出原所在辖区的;三是已备案的医疗器械管理类别调整为第二类、第三类和不作为医疗器械管理的;四是《营业执照》被依法注销或吊销的;五是备案人开展产品再评价工作的结果表明,已上市产品不能保证安全、有效的。同时明确,备案人未按要求取消备案的,备案部门可以公告取消备案。
因《第一类医疗器械备案凭证》变更为《第一类医疗器械备案编号告知书》导致企业现有库存产品标签、说明书和包装材料的文字性改变,如备案编号由“京东械备20210012号”变更为“京东械备20210012”的情形,可继续使用至2023年8月31日,但标签、标识和说明书内容应当符合现行法律、法规、规章和强制性标准的规定。
本通知内容经过多次内部讨论,对主要内容、可操作性进行了研究,形成了征求意见稿,现向社会公开征求意见。









