为加强医疗器械产业健康发展,早在2012年国务院就印发了《“十二五”国家药品安全规划》,要求“启动高风险医疗器械国家统一编码工作。经过多年进一步研究规划,于2019年7月国家药监局会同国家卫生健康委联合印发《医疗器械唯一标识系统试点工作方案》,拉开我国医疗器械唯一标识系统建设序幕。
从2019年选取部分重点品种开始进行UDI试点到2022年三类全面实施UDI,3年来UDI实施品种不断扩展,实施范围持续扩大,实施内容进一步细化,实施方式进一步成熟,应用场景进一步扩大。
2022年,在医疗器械全产业链上持续推广应用的过程中,UDI也出现了一些新的变化,本期就让我们一起来看下2022年UDI发展变化的八大概况!
国际上,早在2011年国际医疗器械监管机构论坛(International Medical Device Regulators Forum,IMDRF)就已经成立,并于2013年12月发布《UDI指南》,拉开了全球实施UDI 的序幕。由于《UDI 指南》只是一个框架性文件,不包括具体应用层面的指导,因此2019年3月IMDRF又批准发布了《医疗器械唯一标识系统(UDI系统)应用指南》,为全球实施UDI提供了一个共认的技术框架建议,这有助于建立全球互认的医疗器械唯一标识系统。
目前,UDI 作为解决医疗器械全球监管问题的通用语言,其重要性已被越来越多的国家所认识,全球UDI 实施步伐正不断迈进。美国从2007 年起就提出实施UDI 原则要求,欧盟(EU)也于2021年开放数据库并要求强制使用欧盟医疗器械数据库,按照医疗器械产品的类型和风险等级,对所有医疗器械实施UDI,为追溯创造条件。除此之外,中国、巴西、加拿大、澳大利亚、中国台湾、新加坡、日本、韩国、印度、沙特阿拉伯等十来个国家和地区均已有UDI相关法规出台,对UDI实施做出了明确规定。
经过2022年一年的实施,以及此前试点和第一批实施的品种,除新近申请注册证的三类医疗器械外,目前国内已基本完成所有三类医疗器械的实施工作。同时,也有一些二类和一类的医疗器械产品率先完成了UDI实施工作。
截至发文前,国家药监局数据库中已申报完成了2564420份DI,其中器械类占比96.49%,体外诊断试剂类占比3.51%。从产品类别来看,已发码产品几乎都为耗材类,占比高达98.25%。全国范围内已有4000多家企业完成了UDI实施,占全国医疗器械企业的七分之一左右。其中,作为大量医疗器械企业聚集的江苏省、广东省和上海市已实施UDI企业数排名全国前三。此外,根据目前市场上流通的UDI码可以看出,目前医疗器械产品的编码体系主要为GS1和MA码。
目前,携带UDI码的医疗器械产品已正式上市流通使用。其中以近期爆火的新冠抗原检测试剂为代表,在UDI正式应用流通的同时还搭载了其他功能,比如通过扫UDI码查询真伪、通过唯一标识上传抗原数据等。
UDI的推行有利于实现透明化、可视化、智能化的医疗器械全流程监管,从推广范围来看,目前全球发达国家实施医疗器械全生命流程监管已是大势所趋。
在全球范围内,UDI实施的时间表和截止日期往往因市场和产品而异,在一些国家已多次修订,比如美国就曾多次修改UDI实施的截止时间,将I类和未分类器械在标签和包装上履行UDI的要求和向GUDID提交数据的要求,由原先的2018年9月24日最终推迟至2022年12月8日执行。这意味着2022年12月8日后,美国所有医疗器械产品都需要向FDA GUDID注册产品数据,且产品包装需要具备UDI载体。
以下是目前收集到的全球部分国家UDI合规实施的截止日期,但需要注意的是,这些日期可能会随着参与国调整其计划而进行改变。这里为大家列举了一些不同设备风险等级在近期截止的时间节点。
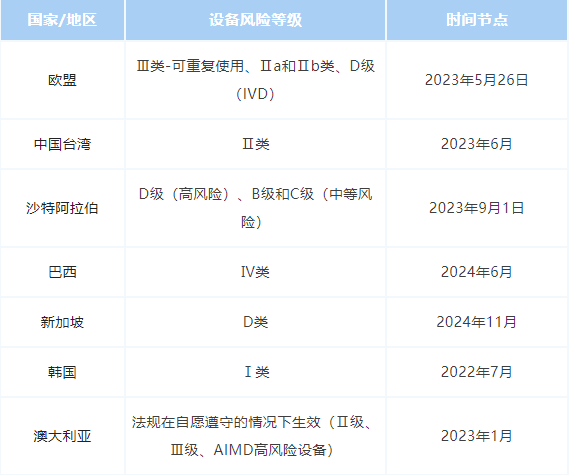
随着国内UDI实施标准和政策要求逐步与国际接轨,医疗器械唯一标识(UDI)正成为各国监管部门加强医疗器械可追溯性管理的标配。就国内而言,自2019年开始试点以来,相继发布了第一批和第二批医疗器械唯一标识(UDI)实施工作政策公告,并于2022年年6月1日实现三类医疗器械的全面实施。
随着UDI的进一步发展,2022年11月底,国家药监局发布了第三批实施医疗器械唯一标识工作的征求意见稿,将国内UDI的实施范围扩展到了二类医疗器械,并公布了共计十五大类141个实施品种,并要求在2024年6月1日前完成。
虽然现在距离第三批实施看起来还有一年多时间,但各企业宜早做准备,不要低估建立唯一医疗器械标识码(UDI)的难度和所需时间、资源。尽可能留给自身充足时间进行产线适配和方案优化,才是稳妥之计。
2022年,是第一批大批量生产企业集中开始正式实施UDI的一年。在这一年里,山东、浙江等多省药监局在UDI实施政策要求的基础上细化了生产企业实施UDI的流程和细则,发布了《医疗器械生产企业 UDI 实施指南》,帮助医疗器械生产企业进一步规范花实施UDI。但由于医疗器械产品种类多、材料多、规格多,鉴于我国UDI 实施尚处于初级阶段,此前实施UDI的企业经验不够充分,实际上各生产企业推进UDI实施的状况是良莠不齐的。
有一些企业考虑到UDI的长远应用,对UDI提前有所了解,因此实施较早,在数据库、追溯等各方面都做的比较完善,早早完成完成了基于UDI的信息化系统升级,在政策规定时间节点前就已顺利完成了医疗器械产品的UDI赋码上市流通。
但也有一些企业由于信息闭塞,未将UDI实施纳入企业计划等原因,在UDI实施上比较落后,在UDI编码体系选择与UDI编码规范制定、UDI 与现有标签系统融合、UDI数据载体印刷赋码、标签质量检测、生产线改造和软件升级等方面问题频出,不仅没有搭建好UDI实施的基础建设,更是未充分考虑流通企业和使用机构在流通和临床使用中最小销售单元与最小使用单位UDI 的异同与关联性、合理性与便利性,导致已赋码上市的产品在经营企业和医疗机构的应用中不是无法扫码出入库,就是增加了流程的繁琐性。
由于UDI贯穿了医疗器械全生命周期环节,也被纳入了医疗器械质量管理体系中。国家药监局2022年发布的《医疗器械生产监督管理办法》、《医疗器械质量管理体系年度自查报告编写指南》等文件中也对UDI追溯的相关内容做出了要求。
后续第三批生产企业实施UDI时可参考第一二批企业的实施经验,充分考虑UDI各实施环节的科学性,再由UDI公共平台根据生产企业需求提供服务,帮助生产企业快速实习UDI 标准化实施。
已赋UDI码的医疗器械产品出场后正式上市首要经过的就是流通环节。关于唯一标识的实施,对于医疗器械经营企业来说,需要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。那么,如何在经营活动中积极应用唯一标识呢?这对于众多医疗器械经营企业来说是一件非常陌生的事情,也无从下手。基于此问题,山东、浙江等多省药监局则发布了《医疗器械经营企业 UDI 实施指南》,进一步细化了实施规范,制定了九大标准化环节帮助医疗器械经营企业进一步规范花实施UDI。
但在实践中,医疗器械流通企业多,规模和质控水平良莠不齐,在应用唯一标识也出现了诸多问题。前期各生产企业在实施UDI时并没有一个统一的标准,UDI实施差异较大,与流通企业基础数据存在普遍性差异;再加上生产企业在包装层级逻辑关联方面往往从自身出发,未考虑流通企业在拆箱出库时可能无法自动拆分,因此导致产品在从从生产企业流通到经营企业时可能存在不匹配的数据,影响产品入库效率,增加流通成本。
在后续实施UDI的过程中,一方面生产企业实施应提前考虑下游流通企业扫码出入库需求,规范关于大中小包装层级、新旧注册证、标签/ 合格证/ 一二维/ 单双行等编码逻辑规则的实施应用,在UDI公共平台指导下,完善产品包装关联基础设置,帮助企业通过系统自动逐一对应包装逻辑关系,无需手工录入或人工备注,便可实现全流程精准追溯。另一方面,医疗器械流通企业也可通过第三方平台更新系统,建立标准化数据库,实现数据对码,减少UDI人工操作环节。
医疗器械供应链管理的首要任务便是保障医疗器械质量安全。医疗器械从注册、生产到流通环节所有信息最终汇聚于医疗机构,是UDI 实施的“最后一公里”,是“四码映射”的主战场。对于医疗机构来说,需要在临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。从而优化医疗器械供应链质量控制的全流程,保障患者用械安全。随着UDI编码与国家医保编码的协同推动,UDI的应用效果也逐渐显现。
但由于各医院信息化队伍的强弱情况、对信息化水平的重视程度、对信息安全的开放程度和系统实施经费预算等客观因素制约,医疗机构对推进UDI 政策落地的主动性和积极性也呈现参差不齐的情况。
医用耗材管理事关人民群众健康,医疗机构可更积极地面对大型医疗器械流通企业提供的战略合作。结合医疗机构耗材精细化管理需求,搭建基于UDI 的医院物资管理系统,解决医疗机构UDI落地难和耗材管理粗放的问题。利用技术手段和软件功能设计“院外供应商协同平台”和院内医院物资管理系统,利用UDI 打通院内院外信息孤岛,并在院内各信息系统中实现贯通,实现医疗器械耗材全生命周期的可追溯。
医疗器械种类繁多,从源头生产到临床使用链条冗长,通过“身份证”的应用,打通生产、流通、使用各环节,让每一环节真正实现一码联通,是UDI实施并应用的目的之一。
医疗器械唯一标识(UDI)作为贯穿全流程的统一编码,从来就不是孤立的。信息化、精细化管理,医保结算,耗材采购,每一道关卡、每一个环节都参与其中。对于企业来说,加快唯一标识的实施与建设,并且在实施初始,就搭建起稳定可拓展的UDI数据库,为以后的“一码通”奠定扎实的基础,是企业阶段工作的重中之重。
2022年医疗器械唯一标识在医药、医疗、医保领域的衔接应用相比过往更加成熟,基于国家药监局已建的UDID数据库平台,随着医疗器械唯一标识加快衔接医保编码,“ 四码映射”进一步完善的情况下,加速信息多码融合,实现医疗器械从生产、流通到终端消耗各个环节的数据对应,通过UDI一码联通进一步促进“三医联动”,相信“一码通”时代并不遥远。
UDI作为万物互联的基础工作,它是我们走向数字化时代的一扇门户,不仅是医疗器械领域,基于UDI的一码联通功能,未来我们还有很多可以想象的空间,让企业从“数字化”走向“数智化”,达成高水平、高效率、高质量的跨越式发展。
UDI 是医疗器械行业近年来最重磅的政策之一,必将通过提升医疗器械全产业链的信息化水平,强化医疗器械产品的可追溯性,推进医疗器械行政主管部门的智慧监管、生产过程的质量控制、流通过程的风险管控和医疗机构的用械安全,助力我国医疗器械产业的高质量发展,为“健康中国”战略保驾护航。
原文始发于微信公众号(艾邦医用高分子):2023IVD行业8大发展趋势!



