Evaluation of a Medical Grade Thermoplastic Polyurethane for the Manufacture of an Implantable Medical Device: The Impact of FDM 3D-Printing and Gamma Sterilization
《用于制造植入式医疗器械的医用级热塑性聚氨酯的评估:FDM 3D打印和伽马灭菌的影响》
作者:
Marie-Stella M’Bengue, Thomas Mesnard, Feng Chai, Mickaël Maton, Valérie Gaucher, Nicolas Tabary, Maria-José García-Fernandez, Jonathan Sobocinski, Bernard Martel and Nicolas Blanchemain*
来源:
Pharmaceutics 2023, 15(2), 456
转自:
https://www.mdpi.com/1999-4923/15/2/456
文章来源网络 如有侵权 请联系删除
Article source network, if there is infringement, please contact delete
摘要
热塑性聚氨酯(TPU)的三维打印(3DP)在医疗行业越来越受到关注,这要归功于TPU展现出的可调特性与3DP工艺在精度、时间和制造成本方面提供的可能性结合。我们通过熔融沉积建模(FDM)研究了医疗级TPU的实施,用于从原始颗粒到伽马(γ)灭菌3DP构造的植入式医疗设备的制造。据作者所知,没有涉及TPU、FDM 3D打印和伽马灭菌的指南/研究。通过差示扫描量热法(DSC)分析的热特性和通过尺寸排阻色谱法(SEC)测量的分子量被用作整个制造过程的监测指标。伽马灭菌后,通过水接触角(WCA)测量和红外光谱(ATR-FTIR)评估表面化学。通过拉伸试验研究机械性能。生物相容性通过细胞毒性(ISO 10993-5)和血液相容性测定(ISO 10993-4)进行评估。结果表明,TPU在制造过程中经历了降解,因为数均(Mn)和重均(Mw)分子量均降低(Mn损失7%,Mw损失30%,p<0.05)。伽马灭菌后,Mw增加了8%(p<0.05),表明可能发生了交联。然而,拉伸性能不受辐照的影响。灭菌后的细胞毒性(ISO 10993-5)和血液相容性(ISO 10993-4)评估显示了细胞活力(132%±3%, p<0.05)并且没有发生红细胞裂解。我们的结论是,伽马射线灭菌不会对TPU的应用产生很大影响。我们的研究证明了FDM后进行伽马灭菌的TPU的可加工性,可用作在制造接触血液的植入式医疗设备中对聚合物原材料进行初步评估的指南。
关键词:医疗器械;3D打印;聚氨酯;消毒; 生物相容性
介绍
3D打印(3DP)指定旨在通过计算机辅助设计构建真实三维对象的过程。3DP长期以来作为一种快速原型技术在汽车和航空工业中使用,现在扩展到其他领域,包括生物医学和制药领域。3DP最初采用各种热塑性聚合物来制造生物材料,例如聚乳酸(PLA)、聚己内酯(PCL)、聚(乳酸-共-乙醇酸)(PLGA)或聚(甲基丙烯酸甲酯)(PMMA) [1, 2,3,4,5]。多个医学专业受到影响,从组织工程到骨科手术、牙科、心血管和颌面外科[4,6,7,8,9]。随着最近的技术进步,更多具有独特性能的聚合物正在通过3DP工艺用于利基应用。事实上,聚芳醚酮(PAEK) [9,10,11] 和热塑性弹性体(TPE) [12,13] 等聚合物系列因其特殊的机械性能而受到越来越多的关注。此外,具有形状记忆特性的特种聚合物复合材料(双层包胶PCL-TPU)正在4D打印中设计和实现,这引入了在外部刺激(光、温度或pH环境)下变形3DP构造的概念[14] ]。
热塑性聚氨酯(TPU)是基于脂肪族聚醚链段的大分子,具有高流动性(称为软链段,SS),由刚性芳族基团(称为硬链段,HS)隔开,可以通过形成硬域和结晶来组织。这种特定的组织提供了TPU的弹性特性。根据它们的性质——SS与HS的比率以及这两相之间的分离程度——可以定制TPU的特性。从生物学的角度来看,TPU是一个很好的候选材料,因为它表现出生物相容性和血液相容性[16,17]。它被用作体外和植入式血液接触医疗器械的原材料,例如血袋、导管、血管移植物或动静脉分流器[18,19]。因此,通过3DP工艺实现TPU是一个越来越受关注的话题。TPU提供的广泛特性与快速制造、低成本和高分辨率技术相结合,为医疗行业创造了一个有趣的组合。一些研究通过熔融沉积建模(FDM) [20,21,22]报告了TPU的操作条件。这是一个广为人知的3D工艺,其基本原理包括通过连续分层熔化聚合物来构建3D结构。实际上,在低于其熔化温度时,TPU是由(或多或少半)结晶簇构成的双相材料,其中HS通过π-π堆叠相互作用聚集形成硬域,散布在SS链缠绕的非晶相中,形成软域[15]。
在植入式医疗设备的制造过程中,基于聚合物的植入物将作为制造过程的一部分进行灭菌。常用的灭菌方法有环氧乙烷或蒸汽气体灭菌、伽马射线或电子束辐照灭菌等,以消灭活微生物,避免感染。文献[22,23,24,25,26,27]中详细报道了使用电离辐射对TPU进行灭菌的效果。断链或键断裂和交联或键的形成是数值研究中发现的两个主要现象以及分支[22,23,24,26,27,28]。它们对材料很敏感,并且经常会同时发生,从而导致聚合物的化学、热和机械性能发生变化。根据灭菌过程、接受剂量的强度和材料的性质,这些现象相互竞争,因此,TPU会发生脆化、增韧、硬化或软化和变色[22,23,24,26,27,28]。医疗行业还需要严格监控制造过程,以解决可靠性和再现性问题。事实上,当属性发生变化时,必须对其进行识别和限制,以保证植入设备的安全性和质量[5]。临床表现明显依赖于性状变化;因此,评估制造过程的影响及其程度非常重要。
本研究的目的是评估熔体挤出3DP技术和常用灭菌方法作为植入式医疗器械制造路线对TPU的影响。本研究完成后对最终灭菌样品的生物学特性进行了初步评估。我们研究了FDM对医用级TPU从原始颗粒到伽马(γ)灭菌3D部件的影响。通过尺寸排阻色谱法(SEC)测量的分子量和通过差示扫描量热法(DSC)评估的热特性被用作该过程每个步骤的监测指标。通过水接触角测量(WCA)和红外光谱(ATR-FTIR)研究了灭菌3D部件的表面特性,并通过拉伸测试研究了机械特性。此外,分别根据ISO10993-5和ISO10993-4标准通过细胞毒性和血液相容性测定进行生物学评价。
据作者所知,没有这样的研究(i)提供有关FDM 3D打印后伽马灭菌对医用级TPU的物理化学性质的影响的数据;(ii)评估FDM处理和灭菌的TPU结构的细胞毒性和血液相容性。
材料和方法
2.1. 材料
医用级TPU,由巴斯夫(德国莱姆福德)提供的Elastollan®,以原始颗粒形式收到。它是一种聚醚基TPU,以聚环氧丁烷(PTMO)作为SS,4,4-二苯基甲烷二异氰酸酯(4,4-MDI)作为HS,1,4-丁二醇(1,4-BDO)作为扩链剂。HPLC级(≥99.8%)的四氢呋喃(THF)由Honeywell Riedel-de HaënTM(Seelze, Germany)提供。用于制备磷酸盐缓冲溶液(PBS)的碳酸钠(Na2CO3)和盐片由Sigma Aldrich (Steinheim, Germany)提供。HPLC级(≥99.9%)的乙醇由Fisher Chemical(比利时赫尔)提供。
2.2. 样品制备
2.2.1. 3D打印(FDM)
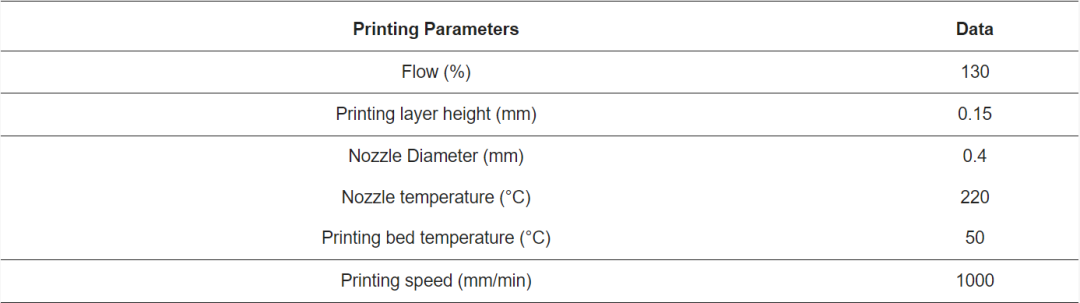
图1总结了TPU部件的制造过程。为了进行FDM,将原始TPU颗粒挤出(荷兰3devo的 Composer 350)成直径为1.75毫米的长丝。确定最佳温度曲线以获得规则直径的干净长丝。根据制造商(BASF,Lemförde,德国)的建议,从进料到挤出喷嘴的挤出温度分别为155°C、175°C、181°C 和185°C。单个挤出螺杆的转速为2.8RPM。管状样品(高度:25毫米;直径:20毫米;壁厚:0.8毫米)使用开源软件(On Shape,波士顿,马萨诸塞州,美国)设计,然后进行切片处理(Simplify3D,美国俄亥俄州辛辛那提),最后使用FDM(Stream 20 Dual MK2,Volumic,法国)从上述灯丝按照表1中的参数进行3D打印。
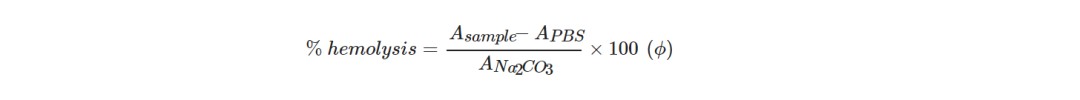
图1. FDM处理的TPU结构的生产路线
表1. TPU构造的FDM处理参数
2.2.2. 消毒
FDM样品根据ISO 11137-2接受剂量为40 kGy的伽马(γ)辐照,以对血管位置的植入式医疗器械进行灭菌。通过暴露于钴60 (60Co)源产生的电离辐射,使用此过程对医疗设备进行灭菌的最低剂量水平为25 kGy。该剂量保证微生物的存活概率小于或等于10^−6。
2.3. 样品表征
2.3.1. 水接触角测量(WCA)
接触角测量是使用测角仪(Minitec DSA100,Krüss,德国)进行的,该测角仪配备了光学系统,可以捕获液滴并分析接触角。使用注射器,使用“Sawsen Sessile Drop”方法将2μL蒸馏水滴在样品表面。测量是在样品的不同区域进行的,以考虑其异质性。在室温下对每个样品进行六次测量。由基线形成的角度,即FDM样品的表面和三相点(固液气)的液滴轮廓的切线是我们的接触角。
2.3.2. 红外光谱(ATR-FTIR)
根据衰减全反射(ATR)方法,通过傅里叶变换红外光谱(FTIR)分析FDM样品。该研究使用红外光谱仪(SpectrumTwo,Perkin Elmer,法国)及其同名相关软件(Spectrum版本10.6.0)进行。该研究在室温下进行,在4000 cm-1至450 cm-1的波数范围内以2 cm-1的分辨率进行16次扫描后,以吸光度模式记录每个研究样品的三个光谱。这些值以ASCII格式从软件中导出,以便在Excel中追踪吸收光谱。
2.3.3. 差示扫描量热法(DSC)
对样品进行差示扫描量热法(DSC Q100,TA Instruments,Guyancourt,France)。在惰性气体(N2,0.8巴)下提供50 mL·min−1的流量,将约5mg样品密封在腔室中的标准铝胶囊中。使用空的标准铝胶囊作为参考。基于具有10°C·min-1斜坡的加热-冷却-加热循环,在−65°C和+260°C之间的温度范围内记录热流随温度变化的热分析图。每个样品进行三个热分析图。玻璃化转变温度Tg取为中点温度,熔化温度取为最大峰值熔化吸热。
2.3.4. 体积排阻色谱(SEC)
使用配备HR-1、HR-3和HR-4色谱柱(500–500,000 g·mol−1)和差示折光仪(Optilab®-T-rEX,Wyatt Technology,Santa Barbara,CA,USA)的WATERS E2695色谱仪(Waters,Waters Corporation,Milford,MA,USA)进行尺寸排阻色谱。该系统使用标准聚苯乙烯溶液校准。将15mg 样品溶解在3mL THF中(n=6)。每升THF添加1mL甲苯。随后,将这些测试溶液通过孔径为0.45μm的PTFE膜过滤,然后转移到玻璃瓶中。使用Astra 6软件(Astra 6,Wyatt Technology,USA)进行数据处理。
2.3.5. 拉伸试验
在平行和垂直于样品打印层的方向上切割哑铃试件(12mm×4mm)。使用的测试台是一台通用牵引机(Instron 4466,美国马萨诸塞州诺伍德),配备了37°C的气候室。拉伸试验以3.5×10-3·s-1的初始应变速率进行,直至样品断裂。 根据与塑料拉伸性能相关的ASTM D638标准,一式三份地进行测试。
2.4. 生物相容性评估
2.4.1. 细胞毒性
根据ISO 10993-5标准,我们的生物材料的潜在细胞毒性通过与人肺微血管内皮细胞(HPMEC)(间接接触)的提取方法进行了评估。将表面积为1.6 cm2的FDM打印矩形样品(经或未经γ灭菌)浸泡在1.066 mL HPMEC细胞完全培养基(CCM)中进行72小时提取,在Innova40振荡培养箱(New Brunswick Scientific, Illkirch, France)上以80 rpm和37°C搅拌。每组样品一式三份。在添加提取培养基的前一天,将每孔含有100 µL CCM和4.0×103个HPMEC细胞的96孔组织培养板在37°C、5% CO2环境中孵育24小时。24小时后,首先对提取介质进行过滤灭菌(0.22µm Filtropur®, Sarstedt, Nümbrecht, Germany)。然后,从单层细胞中去除培养基,并添加每孔100μL的过滤提取培养基或CCM(阴性对照,即缺乏细胞毒性)。
在暴露于提取介质24小时后,通过AlamarBlue®测试方法评估细胞活力。Alamarblue®溶液最初是蓝色和氧化的,当被任何真核细胞中与呼吸活动相关的酶还原时,会变成红色和荧光。简而言之,从细胞中去除提取培养基,在CCM中加入10% AlamarBlue®(ThermoFisher Scientific,Illkirch,法国)每孔200 µL,并在37°C下避光孵育2小时。然后,将每个孔中的150µL AlamarBlue®溶液相应地转移到黑色透明底部的96孔板中,用于在微孔板荧光计上测量激发波长530nm和发射波长590nm的荧光(TwinkleTMLB 970,Berthold Technologies GmbH & Co,Wildbad,德国)。然后将结果相对于阴性对照(CCM)的结果进行标准化,以表示测试组的相对细胞活力。
2.4.2. 血液相容性分析
对于下面的测试,使用19号蝶形针通过静脉穿刺从健康成年志愿者(26岁)采集新鲜人体血液,该志愿者用1.5IU肝素/mL(Leo Pharmaceutical Products BV,Weesp,荷兰)抗凝。
2.4.3. 溶血
当与生物材料接触时,化学物质或可浸出物与红细胞之间的相互作用会导致它们的破坏(裂解)和细胞内血红蛋白的释放,细胞内血红蛋白是红细胞的主要成分,是红细胞呈红色的原因。因此,进行了体外溶血试验以评估材料对红细胞的潜在影响。表面积为2.4cm2的FDM打印矩形样品(有或没有γ灭菌)在37°C下以80 pm的转速搅拌30分钟,用1mL PBS进行预处理。每组样品一式三份。不含样品的PBS用作阴性对照,即不存在溶血,不含样品的0.1% Na2CO3用作阳性对照,即完全溶血。调节后,将样品膜浸泡在每个人全血样品1mL中,然后在37°C下以80rpm的速度搅拌孵育1小时。然后,从每个孔中收集血液并转移到相应的玻璃试管中以500×g离心5分钟。通过使用UV光谱仪(UV-1800,Shimadzu,Marne La Vallee,France)测量在541nm波长下从离心管收集的上清液的吸光度(即游离血红蛋白的吸光度峰)来确定样品的溶血活性。溶血率按照以下公式计算:
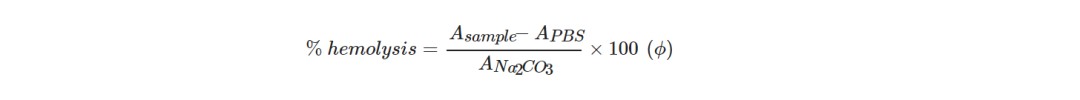
2.4.4. 血细胞粘附
在上述测试中与人体全血接触后,将FDM打印的样品转移到新的12孔组织培养板中。对于SEM观察的预处理,将每个样品浸泡在每孔1mL的2.5%戊二醛溶液中以在4℃下固定30分钟。然后使用不同浓度的乙醇溶液将样品逐渐脱水:50%、60%、70%、80%、90%和100%。在FlexSEM1000扫描电子显微镜(Hitachi,法国)下,电子加速电压为5 kV,发射电流为10μA,放大倍率为×300。
2.5. 统计分析
结果以平均值±标准差表示。使用Excel进行统计分析。为了比较两组,使用双向学生测试(学生t测试)。为了将几个组与对照进行比较,执行单向方差分析(ANOVA单向)。当p≤0.05时,两组或更多组之间的差异被认为是显著的。
结果
3.1. FDM制造工艺和灭菌对TPU的影响
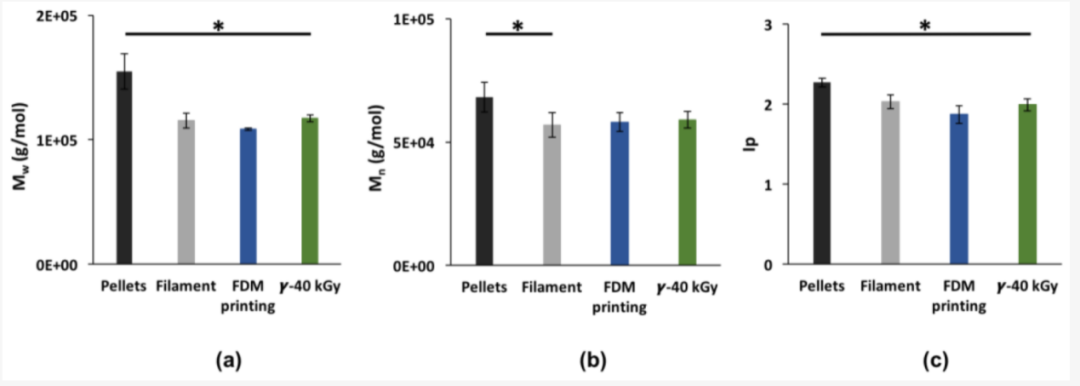
图2. 制造过程对Mw (a);Mn(b); 和IP (c)的影响。数据表示为平均值±SD (n = 6),* p<0.05(每个处理步骤之间,Student t检验)
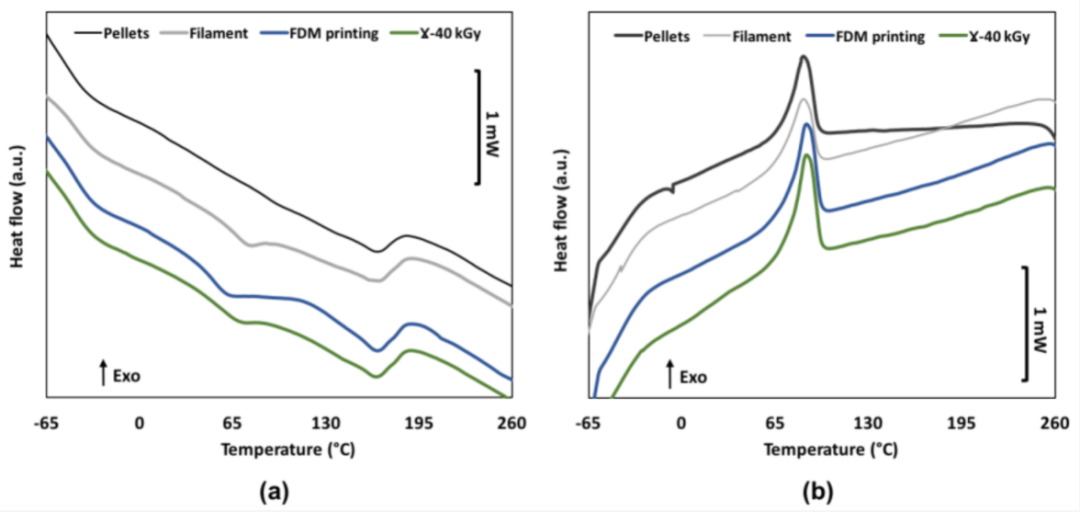
图3. 原始颗粒、挤出长丝、FDM处理和灭菌样品的第一次加热运行(a)和冷却运行(b)的DSC曲线
表2. 从第一个周期收集的DSC数据(n=3)(平均值±SD)
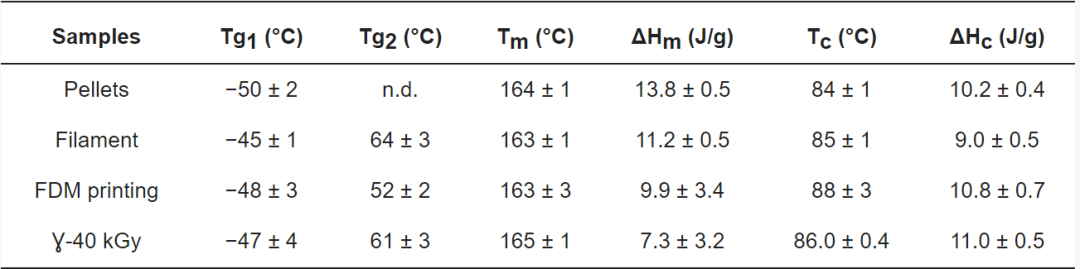
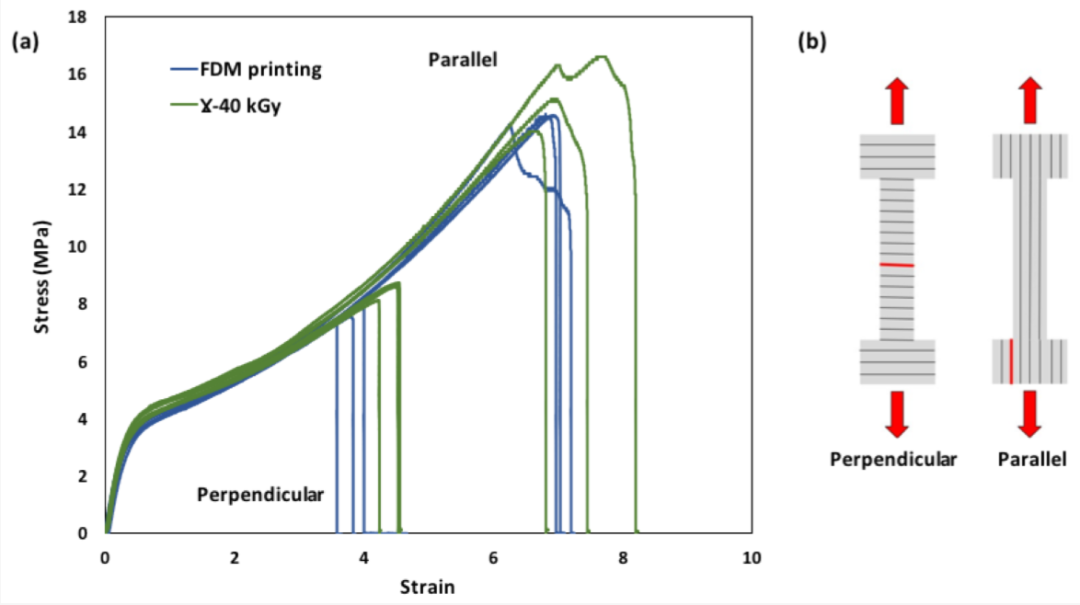
图4. (a) FDM处理和灭菌的TPU样品的拉伸曲线;(b)垂直和平行于打印层切割的哑铃(红线代表断裂位置)
表3. 来自拉伸曲线的数据(n=3):杨氏模量(E)、断裂应力(σb)和断裂应变(εb)(平均值±SD)
3.2. 灭菌3DP样品的表面特性

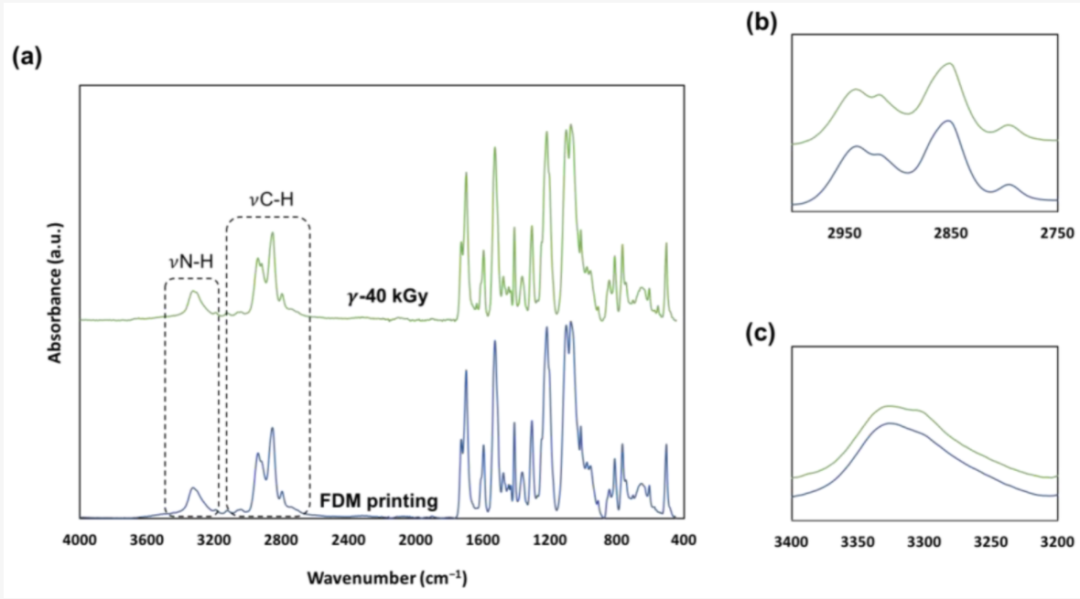
图5. (a) FDM处理和灭菌样品的4000 cm−1至400 cm−1的ATR-FTIR光谱 (b)在2940 cm-1 分裂并从2852转移到2850 cm-1和(c) 3300 cm−1处的外观
3.3. 灭菌3DP样品的生物学特性
3.3.1. 细胞毒性
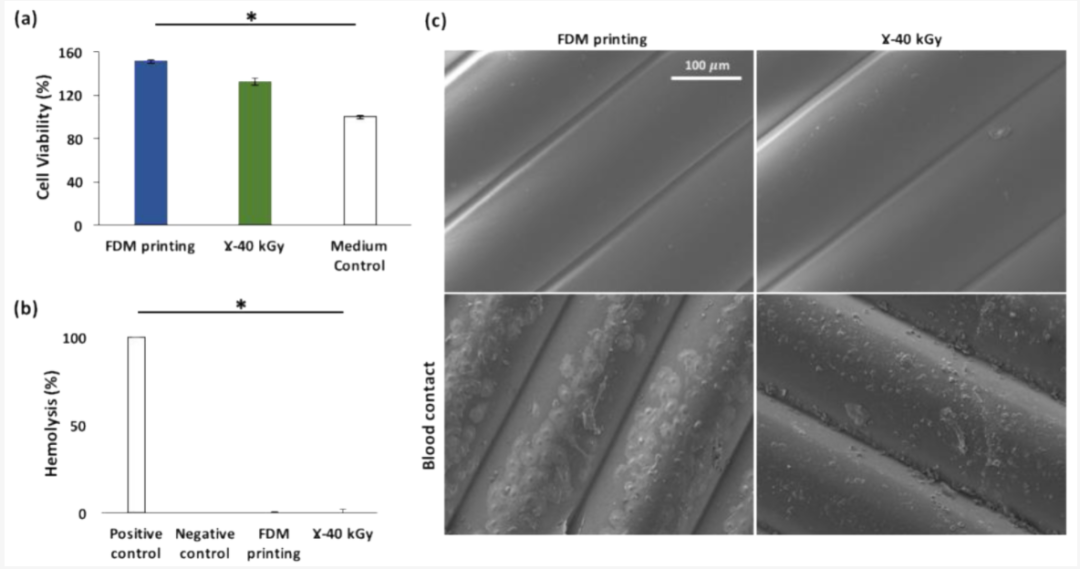
图6. γ灭菌对FDM处理的TPU构造的生物学特性的影响:细胞活力(a);溶血率(b);血液接触后(c)* p < 0.05(与对照相比,ANOVA单向)和FDM处理(没有和没 γ灭菌)的SEM显微照片
3.3.2. 血液相容性
溶血
根据等式(ϕ)计算的溶血率值(图6b)表明,正如预期的那样,阳性对照(即0.1% Na2CO3)产生100%溶血,而阴性对照(即PBS)没有产生任何溶血。关于测试材料,无论有无伽马灭菌,两组都没有表现出溶血活性(0%)。
血细胞粘附
在暴露于人类全血1小时后,在SEM下观察FDM制造的样品(有或无γ灭菌)的表面(图 6c)。虽然发现红细胞粘附在两组的表面上,但材料表面粘附的血细胞最多的是血小板。关于粘附的血小板的形态,在γ灭菌的样品上,它们没有显示出可见的假足;而在未灭菌的FDM样品上,发现扁平和散布的血小板具有大量延伸的伪足。这种形态转变被认为是血小板活化的标志,它首先包括圆形血小板的粘附,然后适度改变形状的血小板或具有假足的树突,然后是血小板的扁平化和扩散[30]。因此,粘附的血小板在未灭菌的FDM样品表面的活化比在灭菌的样品表面更先进。这意味着TPU表面血小板的活化因伽马灭菌处理而减弱。
讨论
我们的研究旨在评估使用3DP技术生产医疗设备时TPU的降解程度。生产路线包括通过FDM将TPU从原始颗粒加工到3D打印,然后通过40kGy剂量的γ辐照对3D结构进行灭菌。
选择FDM是因为医疗级原材料的可用性、使用设施和缩放适应性。在医疗行业,需要对医疗器械的制造过程进行精确监控,以确保所制造的每件产品都具有相同的质量和相同的性能。当我们通过连续打印的3D结构的分子量研究可重复性时,我们证明了FDM是一种可重复的技术。Mn和Mw在多次连续打印后保持不变,从而能够在对挤出流量、打印速度、挤出喷嘴和床温等参数进行彻底优化过程后验证打印参数(补充数据)。在制造过程中,TPU经历了两个具有高剪切应力的连续加工步骤,即挤出和3D打印,以获得管状3D结构。已经证明,随着分子量降低,聚合物降解发生在两个步骤中,直到最终达到Mw的三分之一的累积损失。热分析显示玻璃化转变温度发生变化,即Tg1升高和Tg2降低。这种模式意味着两个连续的处理步骤都可以引入更多的相混合和TPU软域和硬域之间的重新排列。软域中小的或非理想排列的HS的溶解可以解释Tg1的这种升高。Takahara A等人解释说,当该温度接近聚醚链的Tg时,TPU中软域和硬域之间的相分离程度会增加[16]。Abraham等人报道了PTHF均聚物的Tg为-79°C [27]。以同样的方式,对于Tg2,原料颗粒中的HS域不包含无定形链段,因此不能表现出玻璃化转变温度。随着在挤出步骤期间发生结晶相和非晶相重组,HS和SS之间更多的相混合导致可检测的Tg2。Meijs等人解释说,这种现象是通过硬域和软域之间界面处的小规模链断裂发生的[31]。
植入的医疗器械需要无菌。之所以选择伽马灭菌,是因为它是一种常见、高效且在文献中有广泛记载的方法。欧洲药典要求的无菌保证水平是在25kGy的剂量下获得的[32]。3D打印样品以40kGy的剂量进行灭菌。灭菌导致FDM样品发生宏观颜色变化。据报道,受辐照样品变黄是TPU氧化以及疏水性降低的结果[24,29]。根据能量输入的类型,已经提出了TPU的几种氧化机制,包括将双苯基亚甲基转化为具有共轭双键的丙二烯基团[33]。在辐照过程中用氧气进行辐射分解产生的自由基可以启动这些机制[23],而这些发色团结构形成过程中共轭双键的积累是导致颜色变化的原因[34]。通过红外光谱进行的表面特性研究表明灭菌后表面化学发生了变化。在植入式医疗设备的制造过程中,可以预见到添加剂从TPU表面释放到生物介质中,因此必须进行毒性研究。此外,Murray等人[28]在文献中已经证明,交联是通过自由基重组发生的。FDM处理的TPU在辐照后的拉伸性能保持不变。人们可能会认为,随着交联的发生,TPU会变硬并失去柔韧性。Murray等人假设剂量低于200 kGy时无法识别TPU中的交联效应。也有文献记载,商业TPU在达到数百kGy的特定阈值之前表现出耐辐射性[22,23,34]。通过“仅”接受40 kGy的剂量,TPU的弹性体性能保持完好并符合我们的应用。
除了物理和分子行为外,经过FDM处理然后经过γ灭菌的TPU的生物学特性必须足以满足医疗器械的设计目的。灭菌前后的FDM样品未显示溶血活性,使其适用于接触血液的植入物。此外,FDM处理的TPU不仅通过极大地满足提取方法的要求而表现出非细胞毒性行为,而且细胞活力在照射后仍然保持在70%以上的极高水平。众所周知,商业TPU是用润滑剂和抗氧化剂等添加剂配制而成,以达到所需的性能。我们之前提出了EBS润滑剂在灭菌后通过与交联同时发生的小规模链断裂迁移到我们FDM处理的TPU样品表面的可能性。Bernard等人研究了这种润滑剂对环烯烃共聚物生物学特性的影响。对于含有它的牌号,他们发现(i)通过MTT检测HUVEC细胞,细胞活力从175%降低到150%;(ii)观察到较少的粘附和血小板活化[35]。血小板的粘附和活化是血栓形成发生的基本步骤。有趣的是,我们在我们的案例中观察到相同的模式:细胞活力略有降低,血小板活化似乎减少。
考虑到灭菌后的3DP TPU结构表面的血小板粘附和高级活化程度较低,TPU在伽马灭菌后的生物学特性更好。为了进一步筛选,必须评估FDM处理和γ灭菌TPU的体外生物耐久性,因为在加工过程中观察到的分子量降低可能导致机械性能的早期损失。此外,应随时间评估拓扑结构和表面孔隙率的演变,以评估对细胞粘附和增殖的影响[35]。
对于3D打印和伽马射线灭菌的血液接触植入物的设计,TPU似乎是一个可行的候选者,尽管FDM加工在连续加工步骤(即挤出和3D打印)中对其分子完整性产生破坏性影响。使用伽马射线进行的灭菌似乎诱导了交联。尽管如此,TPU的机械性能并未受到影响,生物性能也符合应用要求。经伽马灭菌的样品被发现无细胞毒性且无血栓形成诱导作用,因为在伽马灭菌后样品上发生的血小板活化程度较低。在FTIR分析之后,我们怀疑TPU配方中使用的一种众所周知的润滑剂,即EBS,在材料表面发生了迁移。它在材料表面的存在将在后续研究中进行调查。最终,要通过基于风险评估的方法批准该制造路线,后续研究还应涉及TPU的体外生物耐久性评估和可浸出化合物的分析。

转自:
https://www.mdpi.com/1999-4923/15/2/456
参考文献:
1.Lee, S.J.; Jo, H.H.; Lim, K.S.; Lim, D.; Lee, S.; Lee, J.H.; Kim, W.D.; Jeong, M.H.; Lim, J.Y.; Kwon, I.K.; et al. Heparin coating on 3D printed poly (l-lactic acid) biodegradable cardiovascular stent via mild surface modification approach for coronary artery implantation. Chem. Eng. J. 2019, 378, 122116.
2.Park, S.A.; Lee, S.J.; Lim, K.S.; Bae, I.H.; Lee, J.H.; Kim, W.D.; Jetong, M.H.; Palrk, J.-K. In vivo evaluation and characterization of a bio-absorbable drug-coated stent fabricated using a 3D-printing system. Mater. Lett. 2015, 141, 355–358.
3.Jiang, X.; Wu, S.; Kuss, M.; Kong, Y.; Shi, W.; Streubel, P.N.; Li, T.; Duan, B. 3D printing of multilayered scaffolds for rotator cuff tendon regeneration. Bioact. Mater. 2020, 5, 636–643.
4.Nagrath, M.; Sikora, A.; Graca, J.; Chinnici, J.L.; Rahman, S.U.; Reddy, S.G.; Ponnusamy, S.; Maddi, A.; Arany, P.R. Functionalized prosthetic interfaces using 3D printing: Generating infection-neutralizing prosthesis in dentistry. Mater. Today Commun. 2018, 15, 114–119.
5.Gradwohl, M.; Chai, F.; Payen, J.; Guerreschi, P.; Marchetti, P.; Blanchemain, N. Effects of Two Melt Extrusion Based Additive Manufacturing Technologies and Common Sterilization Methods on the Properties of a Medical Grade PLGA Copolymer. Polymers 2021, 13, 572.
6.Haleem, A.; Javaid, M.; Khan, R.H.; Suman, R. 3D printing applications in bone tissue engineering. J. Clin. Orthop. Trauma 2020, 11, S118–S124.
7.Jiao, Z.; Luo, B.; Xiang, S.; Ma, H.; Yu, Y.; Yang, W. 3D printing of HA/PCL composite tissue engineering scaffolds. Advanced Ind. Eng. Polym. Res. 2019, 2, 196–202.
8.Lal, H.; Patralekh, M.K. 3D printing and its applications in orthopaedic trauma: A technological marvel. J. Clin. Orthop. Trauma 2018, 9, 260–268.
9.Kang, J.; Zhang, J.; Zheng, J.; Wang, L.; Li, D.; Liu, S. 3D-printed PEEK implant for mandibular defects repair—A new method. J. Mech. Behav. Biomed. Mater. 2021, 116, 104335.
10.Oladapo, B.I.; Ismail, S.O.; Bowoto, O.K.; Omigbodun, F.T.; Olawumi, M.A.; Muhammad, M.A. Lattice design and 3D-printing of PEEK with Ca10(OH)(PO4)3 and in-vitro bio-composite for bone implant. Int. J. Biol. Macromol. 2020, 165, 50–62.
11.Oladapo, B.I.; Zahedi, S.A.; Ismail, S.O. Assessing 3D printing of Poly(ether-ether-ketone) and cellular cHAp to increase biointerfaces as a biomedical material. Colloids Surf. B Biointerfaces 2021, 203, 111726.
12.Verstraete, G.; Samaro, A.; Grymonpré, W.; Vanhoorne, V.; Van Snick, B.; Boone, M.N.; Hellemans, T.; Van Hoorebeke, L.; Remon, J.P.; Vervaet, C. 3D printing of high drug loaded dosage forms using thermoplastic polyurethanes. Int. J. Pharm. 2018, 536, 318–325.
13.Rahmatabadi, D.; Ghasemi, I.; Baniassadi, M.; Abrinia, K.; Baghani, M. 3D printing of PLA-TPU with different component ratios: Fracture toughness, mechanical properties, and morphology. J. Mater. Res. Technol. 2022, 21, 3970–3981.
14.Rahmatabadi, D.; Aberoumand, M.; Soltanmohammadi, H.; Soleyman, E.; Ghasemi, I.; Baniassadi, M.; Abrinia, K.; Bodaghi, M.; Baghani, M. 4D Printing Encapsulated Polycaprolactone—Thermoplastic Polyurethane with High Shape Memory Performances. Adv. Eng. Mater. 2022, 2201309.
15.Petrović, Z.S.; Ferguson, J. Polyurethane elastomers. Prog. Polym. Sci. 1991, 16, 695–836.
16.Takahara, A.; Okkema, A.Z.; Cooper, S.L.; Coury, A.J. Effect of surface hydrophilicity on ex vivo blood compatibility of segmented polyurethanes. Biomaterials 1991, 12, 324–334.
17.Kanyanta, V.; Ivankovic, A. Mechanical characterisation of polyurethane elastomer for biomedical applications. J. Mech. Behav. Biomed. Mater. 2010, 3, 51–62.
18.Boffito, M.; Sartori, S.; Mattu, C.; Ciardelli, G. 13-Polyurethanes for cardiac applications. In Advances in Polyurethane Biomaterials; Cooper, S.L., Guan, J., Eds.; Woodhead Publishing: Sawston, UK, 2016; pp. 387–416.
19.Ghanbari, H.; Viatge, H.; Kidane, A.G.; Burriesci, G.; Tavakoli, M.; Seifalian, A.M. Polymeric heart valves: New materials, emerging hopes. Trends Biotechnol. 2009, 27, 359–367.
20.Scholz, P.; Wachtendorf, V.; Panne, U.; Weidner, S.M. Degradation of MDI-based polyether and polyester-polyurethanes in various environments—Effects on molecular mass and crosslinking. Polym. Test. 2019, 77, 105881.
21.Miller, A.T.; Safranski, D.L.; Smith, K.E.; Sycks, D.G.; Guldberg, R.E.; Gall, K. Fatigue of injection molded and 3D printed polycarbonate urethane in solution. Polymer 2017, 108, 121–134.
22.Wady, P.; Wasilewski, A.; Brock, L.; Edge, R.; Baidak, A.; McBride, C.; Leay, L.; Griffiths, A.; Vallés, C. Effect of ionising radiation on the mechanical and structural properties of 3D printed plastics. Addit. Manuf. 2020, 31, 100907.
23.Gorna, K.; Gogolewski, S. The effect of gamma radiation on molecular stability and mechanical properties of biodegradable polyurethanes for medical applications. Polym. Degrad. Stab. 2003, 79, 465–474.
24.Simmons, A.; Hyvarinen, J.; Poole-Warren, L. The effect of sterilisation on a poly(dimethylsiloxane)/poly(hexamethylene oxide) mixed macrodiol-based polyurethane elastomer. Biomaterials 2006, 27, 4484–4497.
25.Nouman, M.; Saunier, J.; Jubeli, E.; Marlière, C.; Yagoubi, N. Impact of sterilization and oxidation processes on the additive blooming observed on the surface of polyurethane. Eur. Polym. J. 2017, 90, 37–53.
26.Mrad, O.; Saunier, J.; Aymes Chodur, C.; Rosilio, V.; Agnely, F.; Aubert, P.; Vigneron, J.; Etcheberry, A.; Yagoubi, N. A comparison of plasma and electron beam-sterilization of PU catheters. Radiat. Phys. Chem. 2010, 79, 93–103.
27.Abraham, G.A.; Frontini, P.M.; Cuadrado, T.R. Physical and mechanical behavior of sterilized biomedical segmented polyurethanes. J. Appl. Polym. Sci. 1997, 65, 1193–1203.
28.Murray, K.A.; Kennedy, J.E.; McEvoy, B.; Vrain, O.; Ryan, D.; Cowman, R.; Higginbotham, C.L. The influence of electron beam irradiation conducted in air on the thermal, chemical, structural and surface properties of medical grade polyurethane. Eur. Polym. J. 2013, 49, 1782–1795.
29.Wetzel, C.; Schönfelder, J.; Schwarz, W.; Funk, R.H.W. Surface modification of polyurethane and silicone for therapeutic medical technics by means of electron beam. Surf. Coat. Technol. 2010, 205, 1618–1623.
30.Goodman, S.L. Sheep; pig; and human platelet–material interactions with model cardiovascular biomaterials. J. Biomed. Mater. Res. 1999, 45, 240–250.
31.Meijs, G.F.; McCarthy, S.J.; Rizzardo, E.; Chen, Y.C.; Chatelier, R.C.; Brandwood, A.; Schindhelm, K. Degradation of medical-grade polyurethane elastomers: The effect of hydrogen peroxide in vitro. J. Biomed. Mater. Res. 1993, 27, 345–356.
32.ISO 11137-2:2013. Available online: https://www.iso.org/cms/render/live/fr/sites/isoorg/contents/data/standard/06/24/62442.html (accessed on 13 May 2022).
33.Wilhelm, C.; Rivaton, A.; Gardette, J.L. Infrared analysis of the photochemical behaviour of segmented polyurethanes: 3. Aromatic diisocyanate based polymers. Polymer 1998, 39, 1223–1232.
34.Jiang, S.; Yuan, C.; Guo, Z.; Bai, X. Effect of crosslink on tribological performance of polyurethane bearing material. Tribol. Int. 2019, 136, 276–284.
35.Bernard, M.; Jubeli, E.; Bakar, J.; Tortolano, L.; Saunier, J.; Yagoubi, N. Biocompatibility assessment of cyclic olefin copolymers: Impact of two additives on cytotoxicity, oxidative stress, inflammatory reactions, and hemocompatibility. J. Biomed. Mater. Res. Part A 2017, 105, 3333–3349.

